FAERS、JADERを利用した薬物性肝関連有害事象の実態の解明 - 1997年-2019年のビッグデータを利用した研究
近年、複数種類の抗腫瘍薬としての免疫チェックポイント阻害剤の出現により、免疫関連副作用(immune-related Adverse Events:irAE)が出現し、薬物性肝障害の定義が混とんとし、薬物性肝障害の被疑薬が整理しづらい状況にありました。
さらに、高齢化社会にともない、6剤以上の内服をしている患者が増加して、これらが肝障害を含めて、薬物有害事象を引き起こしやすい現状があり、ポリファーマシー(「poly」+「pharmacy」)とされ、社会問題となっていました。
これまで、薬物性肝障害という定義は各国のガイドラインなどに沿うかどうかが臨床的に取り入れられていましたが、上記2つの流れがあり、その整理が難しい状態でした。
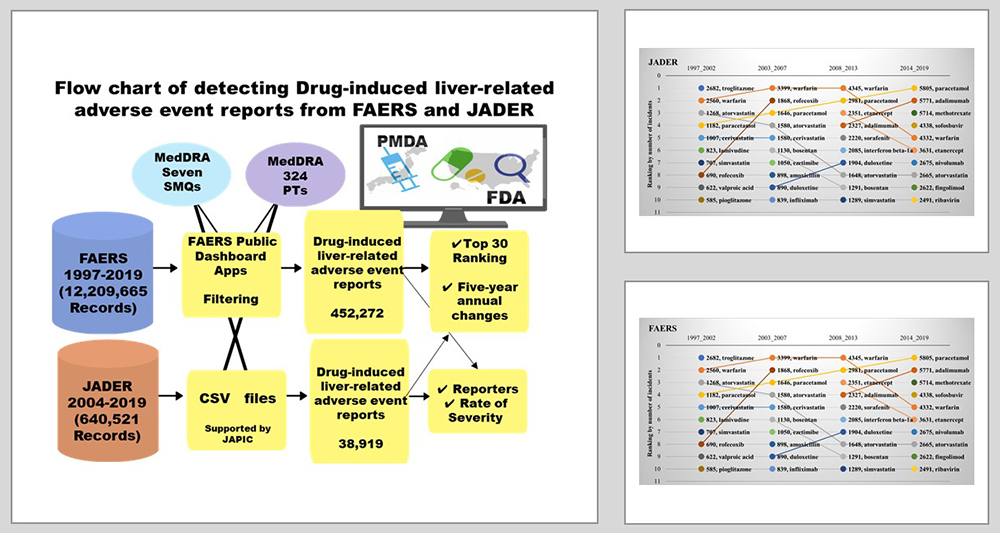
これについて本学医歯学総合病院消化器内科(上村博輝講師、寺井主任教授ら)、明治薬科大学医療分子解析学研究室の研究グループは、国際的に高品質で特異性が高い標準化された医学用語集MedDRAに登録された肝関連有害事象として報告されるPT(注1)243種類に同定して、米国食品医薬局(FDA)によるFAERS(注2)と日本国内の医薬品医療機器総合機構(PMDA)によるJADER(注3)のデータベースを用いて、薬物性肝有害事象という概念を取り込み、両データベースにおける国際比較を行いました。
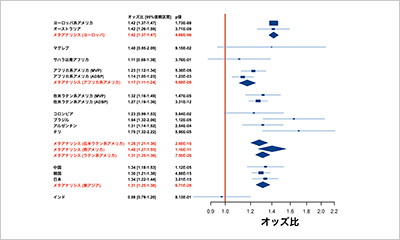
1997年から2019年までのFAERSに登録された452,272例において、ワルファリン、パラセタモール、および アダリムマブは肝有害事象に最も関連する薬剤でした。2004年から2019年までのJADERに登録された38,919症例ではソラフェニブ、ニボルマブ、ハーブエキスが肝有害事象と最も関連性の高い薬剤でした。両データベースにおける順位ランキングの相関性はなく、JADERにおける新規薬剤の報告が目立ちました。報告者についてはFAERSが購入者や代理弁護士から構成される消費者が48%を占めるのに対して、JADERは91%が医療機関もしくは企業報告であり、市販後調査報告が大半を占めていることが示されました。また報告後転帰についてはFAERSが重症例43%を占めているのに対して、JADERは回復、軽快例が83%を占めており、こちらも市販後調査報告が大半を占めていることが予想されました。
以上のように、本研究グループは、日本、米国でのビッグデータ解析により、薬物性肝有害事象という概念で、上位30品目についてのランキング、5年毎のトレンドを整理するとともに、そのデータの背景に隠されたシステムの問題などを明らかにしました。 本研究成果は、2023年1月20日に日本肝臓学会の科学誌「Hepatology Reserch」に掲載されました。
【用語解説】
(注1)PT(Preferred terms):ICH国際医薬用語集 基本語
(注2)FAERS(Food and Drug Administration Adverse Event Reporting System):米国FDA(米国食品医薬品局)有害事象(副作用)レポート
(注3)JADER(Japanese Adverse Drug Event Report):独立行政法人医薬品医療機器総合機構(PMDA)医薬品副作用データベース
論文情報
【掲載誌】Hepatology Reserch
【論文タイトル】Analysis of drug-induced liver-related adverse event trend reporting between 1997 and 2019
【著者】Hiroteru Kamimura,Toru Setsu, Naruhiro Kimura, Makoto Miyazawa, Shota Kaneko, Kenya Kamimura, Atsunori Tsuchiya, Yoshihiro Uesawa, Shuji Terai
【doi】10.1111/hepr.13883
本件に関するお問い合わせ先
広報室
E-mail pr-office@adm.niigata-u.ac.jp