ミトコンドリアオートファジーの制御機構を解明
本学大学院医歯学総合研究科機能制御学分野の大学院生Aleksei Innokentev(アレクセイ インノケンチエフ)、古川健太郎特任助教、神吉智丈教授らの研究グループは、Far複合体(注1)と呼ばれる因子を介したミトコンドリアオートファジー(注2)(以下、マイトファジー)の制御機構を解明しました。マイトファジーは、傷害を受けたあるいは余剰に存在するミトコンドリアを分解することで、ミトコンドリアの恒常性を維持する重要な細胞品質管理機構です。本研究は、マイトファジー制御機構の全容解明へ新たな道を拓き、老化やミトコンドリア機能低下が関わる様々な疾患の予防・治療の糸口となる成果です。
本研究成果のポイント
- Far複合体は、ミトコンドリアと小胞体の両方に存在し、前者はマイトファジーの制御に関与し、後者は栄養シグナル伝達経路に関与するという機能の使い分けをしている。
- 脱リン酸化酵素Ppg1は、マイトファジーレセプター(注3)Atg32の脱リン酸化(注4)だけでなく、Far複合体全体の会合にも重要である。
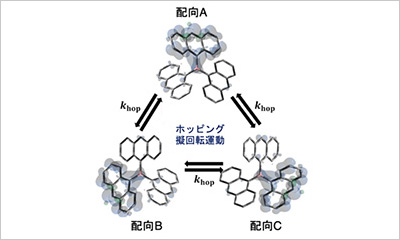
- Far複合体のうちFar8がAtg32と直接結合し、これらの結合と解離の状態変化がマイトファジー制御の鍵である。
【用語解説】
(注1)Far複合体: Far3-7-8-9-10-11の6タンパク質から構成される。ヒトではSTRIPAK複合体として知られており、その欠損は様々な疾病に関連することから、近年注目を集めている。
(注2)オートファジー: 細胞質成分をオートファゴソームと呼ばれる二重膜で包み込み、液胞あるいはリソソームで分解し、栄養源の再利用や傷ついた細胞小器官を排除する生理機能である。オートファジーは、細胞質成分を非選択的に丸ごと分解するバルクオートファジー、細胞小器官や特定の酵素のみを選択的に分解する選択的オートファジーに分類され、本研究では、ミトコンドリアを選択的に分解するマイトファジーに焦点を当てている。
(注3)マイトファジーのレセプター: ミトコンドリア上に存在するマイトファジーの目印となるタンパク質。出芽酵母ではAtg32、分裂酵母ではAtg43、ヒトではNix、BNIP3、FKBP8、FUNDC1、Bcl2-L-13などが存在する。
(注4)リン酸化と脱リン酸化: 多くのタンパク質は、特定のアミノ酸(セリン、スレオニン、チロシン)がタンパク質リン酸化酵素によってリン酸化という修飾を受けることによって、その立体構造が変化し、活性の上昇や低下あるいは他のタンパク質との結合や解離などが起こる。リン酸化されたタンパク質は、脱リン酸化酵素によって脱リン酸化される。
研究内容の詳細
ミトコンドリアオートファジーの制御機構を解明(PDF:699KB)
論文情報
【掲載誌】eLife
【論文タイトル】Association and dissociation between the mitochondrial Far complex and Atg32 regulate mitophagy(ミトコンドリア型Far複合体とAtg32の結合と解離がマイトファジーを制御する)
【著者】Aleksei Innokentev#, Kentaro Furukawa#,*, Tomoyuki Fukuda, Tetsu Saigusa, Keiichi Inoue, Shun-ichi Yamashita, and Tomotake Kanki* (アレクセイ インノケンチエフ#、古川健太郎#,*、福田智行、三枝徹、井上敬一、山下俊一、神吉智丈*) #同等貢献、*責任著者
【doi】10.7554/eLife.63694
本件に関するお問い合わせ先
広報室
電話 025-262-7000